


Cybersecurity - Life Sciences
Soyez prêts pour les nouvelles exigences FDA en
cybersécurité des dispositifs médicaux.
Êtes-vous prêts pour les nouvelles exigences FDA en cybersécurité ?
Êtes-vous prêts pour les nouvelles exigences FDA en cybersécurité ?


Transformez la contrainte FDA-Cyber en levier de conformité maîtrisée.
Alors que la plupart découvrent ces exigences dans la douleur, il est encore temps de structurer votre conformité avec clarté.
Conformité accélérée pour vos soumissions FDA.
Conformité accélérée pour vos soumissions FDA.
Conformité accélérée pour vos soumissions FDA.
Réduisez les délais de 510(k) grâce à des livrables cyber complets dès la première soumission.
Moins d’itérations, moins d’allers-retours avec la FDA.
Réduisez les délais de 510(k) grâce à des livrables cyber complets dès la première soumission.



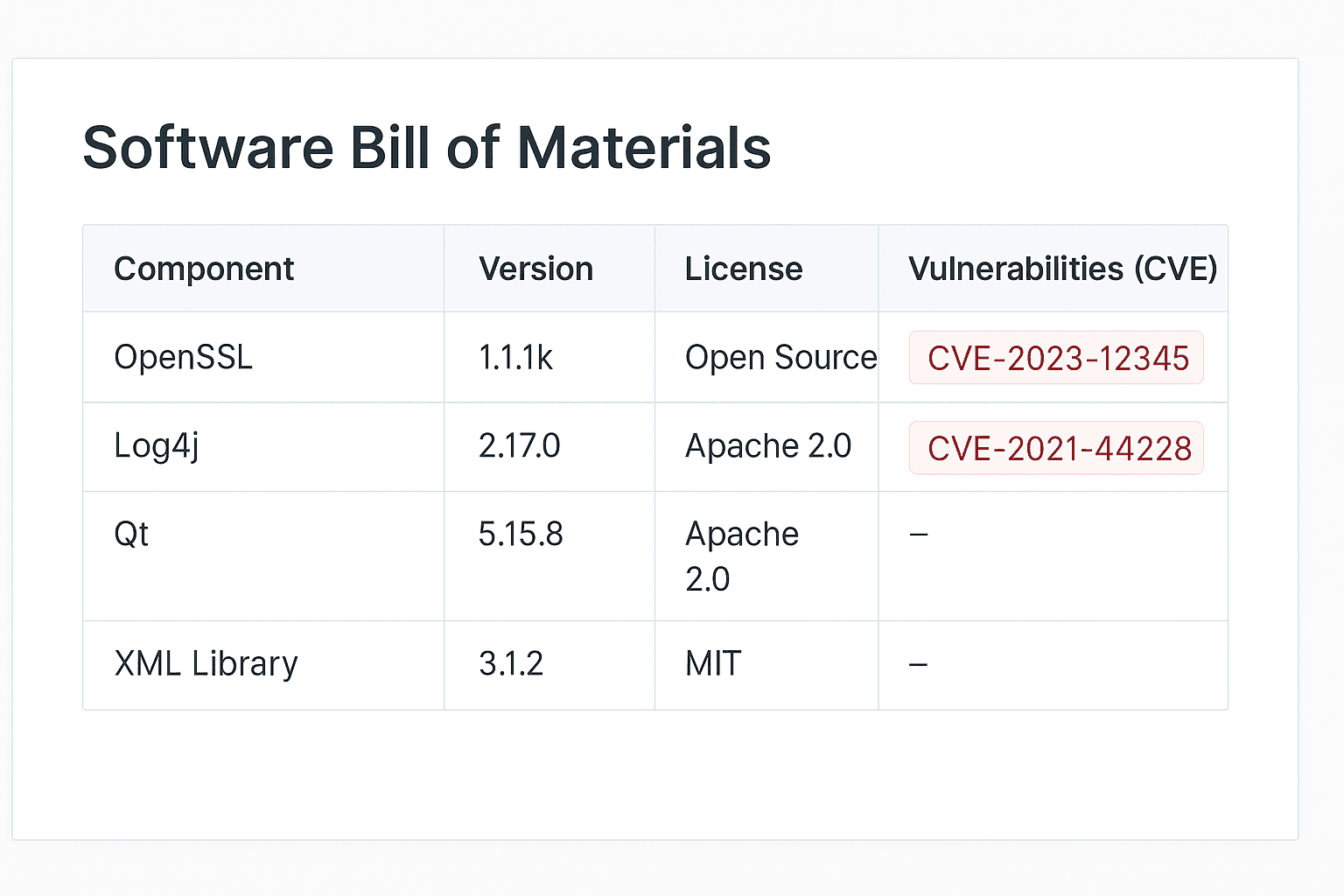


Réduction des risques d’observations.
Réduction des risques d’observations.
Réduction des risques d’observations.
Évitez les observations 483 et les non-conformités liées à la cybersécurité.
Vos preuves sont prêtes, vos contrôles documentés, vos écarts fermés.
Évitez les observations 483 et les non-conformités liées à la cybersécurité.
Vos preuves sont prêtes, vos contrôles documentés, vos écarts fermés.
Crédibilité renforcée auprès des auditeurs.
Crédibilité renforcée auprès des auditeurs.
Crédibilité renforcée auprès des auditeurs.
Vous présentez un dossier cyber maîtrisé et aligné sur les normes 81001-5-1 et 14971.
Chaque inspection devient une démonstration de rigueur, pas une épreuve.
Vous présentez un dossier cyber maîtrisé et aligné sur les normes 81001-5-1 et 14971.
Chaque inspection devient une démonstration de rigueur, pas une épreuve.



Nous opérons à l’intersection de la réglementation et de la cybersécurité.
FDA Cybersecurity Guidance (2023 & 2025)
Intégration du Secure Product Development Framework (SPDF) sur tout le cycle produit.
Rédaction des cybersecurity requirements exigées dans les soumissions 510(k).
Création du plan post-market : surveillance, patching, disclosure, SBOM updates.
Alignement complet sur la section 524B du FD&C Act (Refuse-to-Accept readiness).
IEC 81001-5-1 (2023)
Application de la risk-based approach intégrée à la gestion qualité.
Rédaction des Security Requirements et Verification Plans selon 81001.
Validation de la sécurité logicielle dans les processus de développement
User Experience Testing
Responsive Design Solutions
ISO 14971:2019
Extension du risk management aux menaces cybersécurité
Construction de la risk traceability matrix jusqu’aux exigences FDA Cyber
Documentation des mesures de contrôle et preuves de vérification
Harmonisation avec le risk file global MDR + 510(k)
CyberW96 (FDA recognition list)
Application des best practices de durcissement et d’analyse de vulnérabilités
Alignement des tests avec les CVE/CVSS et la taxonomie NIST SP 800-53.
Construction du plan de vérification et validation (V&V) orienté FDA review
Documentation des résultats en format compatible submission 510(k) / De Novo
FDA Cybersecurity Guidance (2023 & 2025)
Intégration du Secure Product Development Framework (SPDF) sur tout le cycle produit.
Rédaction des cybersecurity requirements exigées dans les soumissions 510(k).
Création du plan post-market : surveillance, patching, disclosure, SBOM updates.
Alignement complet sur la section 524B du FD&C Act (Refuse-to-Accept readiness).
IEC 81001-5-1 (2023)
Application de la risk-based approach intégrée à la gestion qualité.
Rédaction des Security Requirements et Verification Plans selon 81001.
Validation de la sécurité logicielle dans les processus de développement
User Experience Testing
Responsive Design Solutions
ISO 14971:2019
Extension du risk management aux menaces cybersécurité
Construction de la risk traceability matrix jusqu’aux exigences FDA Cyber
Documentation des mesures de contrôle et preuves de vérification
Harmonisation avec le risk file global MDR + 510(k)
CyberW96 (FDA recognition list)
Application des best practices de durcissement et d’analyse de vulnérabilités
Alignement des tests avec les CVE/CVSS et la taxonomie NIST SP 800-53.
Construction du plan de vérification et validation (V&V) orienté FDA review
Documentation des résultats en format compatible submission 510(k) / De Novo


